臨床試驗合約
進案、審案、核准流程
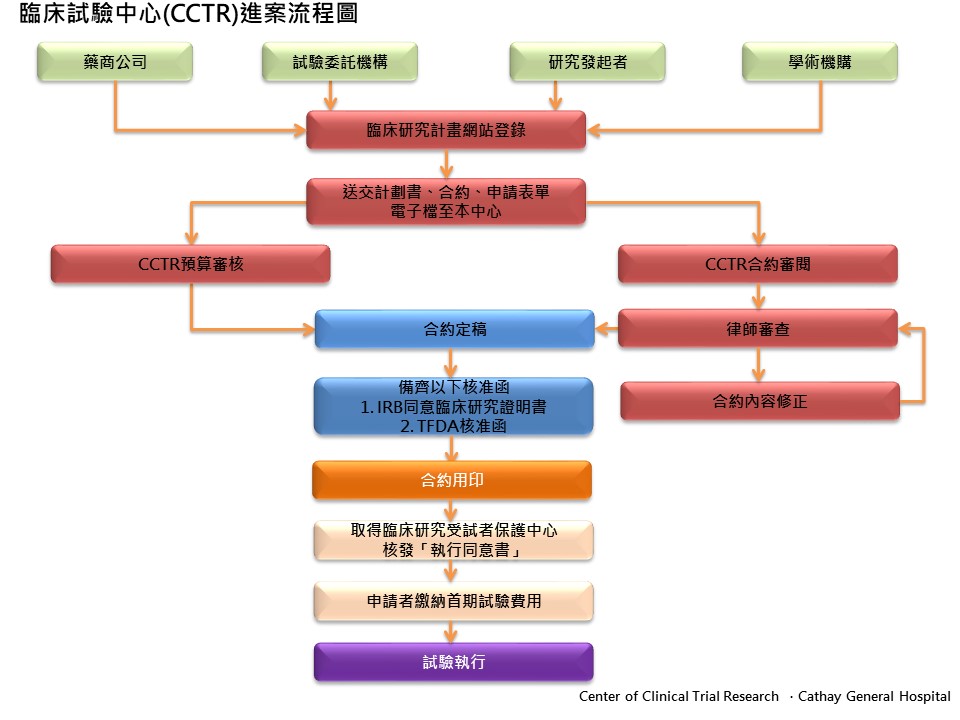
臨床研究與試驗計畫合約申請注意事項:
壹、本院可接受IRB及臨床試驗合約及預算平行送審,縮短行政作業流程。
貳、合約及預算審查須準備文件
一、臨床試驗合約草案(可使用本院合約範本修改,合約範本) 。
二、臨床試驗計劃書(IRB版) 。
三、臨床試驗簽約暨執行證明書申請表(含條文檢核表) 。
四、臨床試驗經費總預算表(含「臨床試驗經費支付明細表」、「付款時程表」、「經費繳款與計畫核銷注意事項」等) 。
五、請將上述電子檔寄至cathaydmr@gmail.com,進行簽約申請。
参、 合約簽署事項說明
一、請先至本中心申請網站登錄試驗案資訊(研究計劃登錄入口) 。
二、臨床試驗執行申請過程中所需檢附之所有電子檔文件,申請人皆為試驗主持人,檔名開頭皆需本院IRB編號(格式: IRB編號-檔案名稱-yyyymmdd;例如:CGH-CS105000-臨床試驗簽約暨執行證明書申請表-20161010) 。
三、本院正式名稱與地址
機構抬頭:國泰醫療財團法人國泰綜合醫院
Cathay General Hospital,
機構地址:10630 臺北市仁愛路四段280號
Mailing address:No.280, Sec. 4, Ren’ai Rd., Da’an Dist., Taipei City 10630, Taiwan (R.O.C.)
四、本院試驗合約須為中文版,內需含本院必備條款;如同時含有中/英文版,則以中文版為主,請於翻譯時力求一致。
五、建議合約使用本院範本,可加快審查速度。
六、「臨床試驗簽約暨執行證明書申請表」內含合約檢核表, 於申請時請核對內容是否具備必要之條款。
七、若簽約者為受託研究機構,需提供試驗委託者授權書中/英文版本與合約草稿一同審查。
八、當完成合約議定,請試驗委託者彙整「臨床試驗預算經費」、「臨床試驗計畫合約書」最終版本與檢附人體試驗審查委員會「同意臨床研究證明書」之電子檔送交,待確認內容後,再由中心人員通知進行合約書簽署與用印事宜。
九、合約生效後欲更改合約內容,視預定變更的內容而定,以新約議約或新增附約方式處理。
十、合約生效應在IRB核准函的核准日期之後,本院機構負責人(院長)的簽署日期為準。
肆、經費編列注意事項
一、各項試驗經費須包含10%行政管理費,並加入5%營業稅。
二、若需使用臨床試驗中心設備,需編列臨床試驗中心儀器設施使用費於預算中。
三、若需本院代管理臨床試驗用藥,需編列藥品管理費用於預算中(可參考收費標準單),並與本院臨床試驗藥品管理師聯繫(#3829)。
四、若需委託本院執行檢驗部分,請參考委託檢驗費用一覽表,並與本院臨床病理科聯繫(#3881)。
伍、其他注意事項國泰綜合醫院的行政系統設置,臨床試驗中心與人體試驗審查委員會各為獨立單位,其相關業務,臨床試驗中心無法代為處理,請直接洽詢人體試驗審查委員會。